
本制品是一种快速、便捷、高效地制备毕赤酵母感受态细胞并进行质粒转化的试剂盒。进行毕赤酵母转化时,使用试剂盒中提供的缓冲溶液培养酵母细胞,使其处于待转化状态,然后将感受态细胞与待转化的质粒DNA和Carrier DNA混合再使用转化溶液孵育进行转化。Carrier DNA是短的线形单链DNA,在酵母细胞摄取外源质粒DNA过程中能促进质粒进入酵母细胞,还可以保护质粒免于被DNA酶降解。

毕赤酵母具有真核表达系统多方面的优势,包括较好的蛋白翻译后剪切、蛋白折叠及翻译后修饰等,同时具有与大肠杆菌(E.coli)、酿酒酵母(Saccharomyces cerevisiae)一样的易操作性。与昆虫细胞表达系统和哺乳动物细胞表达系统相比,毕赤酵母表达系统快速、高效且经济,通常外源蛋白还具有较高的表达水平。与酿酒酵母相比,毕赤酵母的外源蛋白表达水平往往高10~100倍,并且能进行分泌蛋白的N-连接糖基化修饰,但表达分泌蛋白进行糖基化修饰时的糖链长度是有差别的,毕赤酵母修饰的分泌蛋白的糖链长度通常是8~14个甘露糖残基(Mannose residue),而酿酒酵母修饰的分泌蛋白的糖链长度通常是50~150个甘露糖残基,此外,毕赤酵母很少对分泌蛋白进行O-连接糖基化的修饰。
与大肠杆菌和酿酒酵母等宿主不同,毕赤酵母自身没有稳定存在的游离型质粒,所有的表达载体都要整合到酵母的基因组上,即毕赤酵母转化是通过将质粒DNA整合到酵母基因组的特定位点来产生遗传稳定的转化子。常用的毕赤酵母表达载体通常含有标记基因HIS4,这些载体用限制酶线性化后,在AOX1位点或his4位点进行重组产生His+重组体。
毕赤酵母质粒转化时发生同源重组,需要在目的基因两端连有同源臂。环状质粒在特定位点切开后,整个表达盒前后两端分别具有酵母的同源序列,这样就可以通过同源重组整合到酵母基因组,并通过表达盒中表达的抗性基因进行筛选。事实上,在转化时即使不对载体进行酶切线性化,也能整合到酵母基因组,只是重组的效率很低,而线性化后则可以大大提高在特定位置的同源重组效率。在选择线性化位点时确保插入的目的基因不包含希望用于线性化的限制性酶切位点,不同限制性内切酶消化时产生不同类型的转化子如下表所示。载体线性化的位点往往决定着转化子的表型,转化毕赤酵母GS115菌株后可产生两种转化子His+Mut+及His+Muts,而转化KM71菌株时,由于该菌株为Muts表型,故只产生His+Muts转化子。
| Restriction enzyme | Integration event | GS115 phenotype | KM71 phenotype |
| Sal I or Stu I | Insertion at his4 | His+Mut+ | His+Muts |
| Sac I | Insertion at 5'AOX1 region | His+Mut+ | His+Muts |
| Not I or Bgl II | Replacement at AOX1 locus | His+Muts/His+Mut+ | His+Muts (not recommended) |

| 组分 | 50T | 250T |
| Buffer A | 70mL | 350mL |
| Buffer B | 40mL | 200mL |
| Buffer C | 50mL | 250mL |
| Carrier DNA | 500μL | 2.5mL |
| DMSO | 300μL | 1.5mL |
保存:-20℃,有效期1年。

- 除Carrier DNA外,4℃保存,一年有效。
- 使用Carrier DNA时,可根据转化数量,取出所需用量的Carrier DNA在100℃加热15分钟,然后立即置于冰上,15分钟后即可使用。使用后置于-20℃储存,下次使用时在冰上解冻Carrier DNA并再次煮沸变性。如果每次的使用量很小,可以适当分装后再使用,避免反复冻融。
- 待转化样品的体积通常不宜过大,样品体积过大会导致转化效率下降。
- 感受态细胞对于温度变化非常敏感,需要避免出现不应有的使用说明之外的温度变化。
- 感受态细胞对于机械力非常敏感。加入待转化样品时应轻柔操作,不能使用移液器吹打混匀。
- 通常建议取部分样品进行转化,万一遇到转化失败的情况,还留有样品可以再次进行转化。
- 本试剂盒各组分均经无菌处理,使用时请在超净台中操作,使用完毕注意密封保存,避免污染。

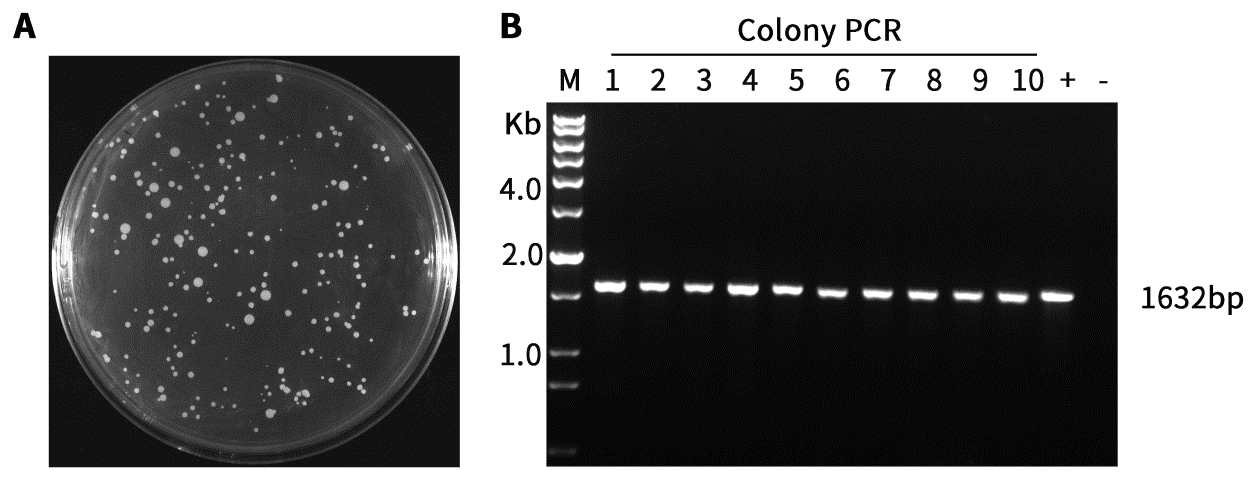
图1.本试剂盒转化效果图。
A.使用本试剂盒制备的毕赤酵母KM71感受态细胞转化带有目的基因的pAOX1-α factor-MCS-His-Zeocin载体培养72小时的平板。
B.图A中的菌落使用酵母菌落PCR筛选鉴定试剂盒(酶解法)进行菌落PCR后的电泳图。将3μg线性化质粒DNA和10μL加热变性的Carrier DNA吹打混匀后加入到使用本试剂盒制备的100μL感受态细胞中,用手指轻弹管底混匀;加入750μL Buffer B,30℃水浴中孵育1小时;室温下2000×g离心10分钟,收集菌体并用750μL Buffer C重悬,再次2000×g离心10分钟,弃上清,轻缓的加入200μL Buffer C并重悬菌体,最后全部涂布于带有Zeocin 抗性的固体培养基表面,30℃倒置培养3~4天,直至出现单菌落。随后用酵母菌落PCR筛选鉴定试剂盒(酶解法)进行PCR验证。1632bp是目的基因片段的扩增条带。M,DNA Ladder(200bp~12kb)。1-10,实验组(PCR模板为酵母单菌落裂解后的菌液);+,阳性对照;-,阴性对照。本制品的实际使用效果会因实验条件、实验材料等的不同而存在差异,图中效果仅供参考。

- 菌种活化:取-80℃保存的毕赤酵母甘油菌在YPD平板培养基上划线,30℃倒置培养2~4天以活化菌种。
- 接种:使用接种环或无菌吸头挑取一个新鲜的酵母单菌落接种到10mL YPD液体培养基中。
- 培养:28~30℃,250rpm培养过夜。
- 再接种培养:将过夜培养的菌液转接至50mL YPD液体培养基中培养,使其起始OD600介于0.1~0.2之间(OD600接近0.1更佳,但后续需要培养更长时间)。30℃,250~300rpm培养4~6小时,使OD600达到0.6-0.8。
注:每10mL菌液可制备4管100μL的感受态。以下操作步骤适用于10mL菌液,感受态具体用量可根据实际情况进行制备。 - 制备感受态细胞:
- 当新鲜培养的菌液OD600达到0.6-0.8时,室温3000×g离心3分钟,弃上清,保留菌体。
- 加入5mL Buffer A溶液重悬菌体,室温3000×g离心3分钟,弃上清,保留菌体。
- 加入400μL Buffer A重悬菌体,按照100μL每管分装于1.5mL无菌离心管中。
- 每管加入5.5μL DMSO并混匀。此时的感受态细胞可直接用于转化,或者将感受态细胞放入程序降温盒中,置于-80℃冰箱缓慢冻存,再将感受态细胞储存于-80℃冰箱中。
注:毕赤酵母感受态细胞一般新鲜制备即用效果最佳。
- 当新鲜培养的菌液OD600达到0.6-0.8时,室温3000×g离心3分钟,弃上清,保留菌体。
- 毕赤酵母转化:
- 将3μg线性化质粒DNA和10μL加热变性的Carrier DNA吹打混匀,然后加入到100μL感受态细胞中,DNA样品的总体积不应超过20μL。
注:如果是冷冻保存的感受态细胞,必须直接向冷冻的未融化的感受态细胞中添加混合的质粒DNA和Carrier DNA。因为感受态细胞解冻后,即使放置在冰上,其转化效率也会迅速下降。如果感受态细胞是新鲜制备的,可直接加入混合好的DNA样品,并混匀。 - 37℃水浴5分钟,孵育过程中上下颠倒混匀1~2次,直到冻存的感受态细胞完全融化。
注:如果感受态细胞是新鲜制备的可忽略此步骤。 - 从37℃水浴取出后,加入750μL Buffer B溶液,轻轻上下颠倒混匀。
- 30℃水浴1小时。约每15分钟上下颠倒或轻弹试管混合样品可以提高转化效率。
- 室温2000×g离心10分钟,弃上清,保留菌体,加入750μL Buffer C重悬菌体。
- 2000×g离心10分钟,弃上清,保留菌体,轻缓加入200μL Buffer C重悬菌体。
- 将重悬的菌液全部涂布于带有适当抗性的固体培养基表面,30℃倒置培养3~4天,直至出现单个菌落。
- 将3μg线性化质粒DNA和10μL加热变性的Carrier DNA吹打混匀,然后加入到100μL感受态细胞中,DNA样品的总体积不应超过20μL。

- 转化效率低的影响因素。
- 毕赤酵母的转化效率会因为菌株差异和质粒整合到宿主染色体的效率以及细胞生长条件而变化。
- 使用高纯的质粒有助于提高转化效率,在某些情况下,适当提高转化的线性化质粒DNA用量(>3μg)可以提高转化效率。
- 细胞密度过低(OD600<0.6),将导致制备的感受态细胞转化效率不佳。
- 孵育时间太短或温度过低。毕赤酵母转化可以在更长的时间(最多3小时)和更高的温度(35~37℃)下孵育。
- 孵育期间未混匀样品。在30℃下孵育1小时的过程中,每15分钟上下颠倒或轻弹试管混合样品可以提高转化效率。
- 毕赤酵母的转化效率会因为菌株差异和质粒整合到宿主染色体的效率以及细胞生长条件而变化。
相关搜索:毕赤酵母感受态细胞制备及转化试剂盒,感受态细胞制备,毕赤酵母感受态细胞,转化试剂盒



